摘要:通过调查铁电池铁电极材料和性能研究现状, 综述了近年来提高铁电极性能方面的研究进展。分析了现有铁电极存在的主要问题并提出了解决方法。特别详细地介绍了锂铁电池铁电极材料制作方法。
关键词:铁电极;添加剂;稳定性;充电效率;电导率
引言
由铁电极构成的电池—铁电池被认为是未来有竞争力的电化学电源,含铁基化合物材料的铁电极决定了铁电池的性能,目前,国内外关于铁电池的研究主要集中在铁电极的研究上[1-15]。铁电极原料易得、价格便宜,经化学反应后的最终产物为铁化合物,不存在废旧电池的二次污染问题。近年来,人们开始加大了对理论容量大、使用寿命长、机械性能好、耐过充放、绿色环保等优点[5]的铁电池铁电极的研究力度。目前,国内外研究的铁电池有高铁、锂铁、铁镍电池。笔者归纳了现有不同体系铁电池铁电极技术及应用。
1 高铁电池
1999 年,Licht 教授等开发了高铁电池 [16- 17],高铁电池是正极材料含高于+3 价的铁基化合物电池,现有高铁电池中的高铁酸盐主要有 K2FeO4、BaFeO4、Na(K)FeO4、Rb(K)FeO4、Cs2FeO4、SrFeO4 和 Ag2FeO4。这类电池主要有 K2FeO4/Mn(VIIorVI)、BaFeO4/Mn(VII)、BaFeO4/MnO2、MFeO4 (M=K2 or Ba)/AgO 等,高铁电池相对容量高是因为高铁酸盐物质在反应中可以得到 3 或 5 个电子 [5]。
反应中得到 3 个电子的体系反应基础为: FeO2- + 3H2 O + 3e- → FeOOH + 5OH- 和 FeO42-+( 5 / 2 ) H 2O + 3e − →4(1 / 2)FeOOH + 5OH − , E = 0.5 − 0.6 V versus SHE[17]。
反应中得到 5 个电子的体系反应基础为: MFeO 4 + (5 / 2)H 2 O + 5e- → M + (1/ 2)Fe 2 O3 + 5OH - 。
高铁电池高铁酸盐 BaFeO4 放电性能好,但稳定性差[18]。要增强高铁电池性能,面临的重大问题是增强高铁酸盐的稳定性,水解、温度、碱度、纯度、杂质等是影响高铁酸盐稳定性的主要因素。在高铁电池中,难溶形态的高铁酸盐在中性、弱碱性溶液中很不稳定,这也是该化学电源体系采用浓碱为电解液的原 PTFE 乳液对高铁酸盐的稳定性是不利的,笔者在此提出以下建议:高铁电池中不用 PTFE因,有研究表明,或用纯的 PTFE、PTFE 的碱溶液甚或 PTFE 乳液加入前有浓碱液存在[19]。BaFeO4 中添加 5%的 KMnO4 可进一步增强它的稳定性。SrFeO4 的情况与 BaFeO4 相似,在室温、干燥、密闭环境下,高铁酸钡稳定性很差,添加剂 Na2MOO4 可以增强高铁酸钡的稳定性[20]。
2 铁镍电池铁电极
1901 年,美国的 Edison 和瑞典的 Junger 同时开发出了铁镍蓄电池[21-22],铁电极为铁镍蓄电池负极,它被认为是未来有竞争力的电化学电源,具有理论容量大(0.96 A•h/g)[14]、使用寿命长、机械性能好、耐过充放等优点[23],但它还存在充电效率低、自放电、析气性严重等问题,因此没有商业化。
2.1 铁镍电池的基本反应原理
铁镍蓄电池中铁电极有 2 个放电平台,基本反应分 2 步。
第一步: 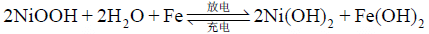
第二步: 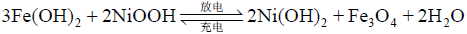
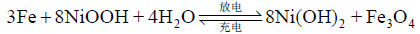
2.2 铁电极存在的问题及解决方法
2.2.1 铁负极的析气问题
制约铁镍蓄电池密封的最大障碍是铁镍蓄电池的铁负极析氢问题,它是铁镍电池自出现以来困扰人们的一大难题,原因是氢析出反应的标准电极电位比铁电极反应的标准电极电位要“正”一些,通过不同电流密度条件下对比氢在不同金属上的析出过电位,发现氢在铁电极上的析氢过电位要比在镉、锌、铅上都“小”。有很多研究者对此做了深入研究,产生了很多成果,主要集中在添加剂的研究上。抑制氢气析出的添加剂主要有:1)电解液添加剂。主要是一些硫化物、硫酸肼、TeO2、HoTeO6、Sb2O5 等 [24-25],这些化合物能够提高氢的析出过电位,其中电解液中的 TeO2 和 HoTeO6 不但能够提高铁电极的析氢过电位、降低铁电极自放电,还有利于提高铁电极的充电效率。2)电极添加剂。在铁电极中加入 FeS、PbS 和 Bi2S3 等添加剂,不仅能抑制氢气的析出,而且能增加放电容量[26-27],其中在电极和电解液中同时含有 Na2S 的多孔铁电极比仅在电解液中添加 Na2S 铁电极具有更大的容量[28]。电极中掺杂 Bi2S3 后,可以增大铁氧化反应的反应电流,使峰电位明显“正”移,减少铁溶解反应的活化能,从而增强铁电极性能。
2.2.2 铁镍蓄电池铁负极的自放电问题
在碱性溶液中铁电极容易钝化,导致形成钝化膜,削弱电极的表面活性,造成电极容量大幅减少,这就是铁电极自放电严重的原因,这时 Fe 生成了 Fe(OH)2,降低了电极活性物质的利用率。目前,解决方法主要集中在添加剂的应用上,FeS、PbS、K2S 等含硫添加剂可以明显减少铁镍蓄电池的自放电。
2.2.3 增加铁镍蓄电池容量问题
增加铁电极放电容量的添加剂:HgO 和 Ni(OH)2,Ni 以 Ni(OH)2 和硫化物的形式存在,在铁电极中有如下作用:1)Ni(OH)2 使铁电极在放电时形成较为分散的 Fe(OH)2 晶格,充电时易于还原。2)在放电时,Ni(OH)2 可以增加阳极氧化深度。3)HgO 和硫化物可以部分地防止铁电极钝化。这些都是增加铁电极容量的有利因素。
2.2.4 解决铁电极充电效率低的问题
铁电极作为铁镍蓄电池的负极材料,充电效率低也是一直困扰人们的一大难题,为解决这一问题,人们做了不同的研究:1)把铁电极做成“袋式”—像个口袋一样将活性物质填充在由穿孔钢带做成的扁盒子里,这种电极的孔率低、反应面积小,导致电极较严重的电化学极化、浓差极化和欧姆极化,影响铁电极的性能。2)用烧结式方法制作铁电极,但此时铁电极的钝化现象更为突出。3)在制作铁粉上下功夫,制得高活性铁粉,增加放电容量,但由于制作工艺复杂,成本无法控制。4)南开大学林东风等研究出电极含 Fe粉 11.75%~47%时,充电效率高于其他比例铁粉含量的铁电极,可达 80.9%~84.4%,充电效率比传统铁电极电池提高了 30%左右[29]。5)通过调整铁电极中铁粉、导电剂石墨、黏合剂含量比例和电解液中添加剂 LiOH含量比例,充电效率比传统铁电极提高了 30%左右[30]。
2.2.5 解决铁镍蓄电池极片膨胀的问题
铁电极极板膨胀问题—由于在反复充放电过程中导致极片膨胀和电极活性物质脱落—是决定电池寿命的主要因素,关于这方面的研究报道少一些。Westinghouse 公司研究人员在电极中添加 NiSO4,收到良好的稳定性效果;也有人采用平板状隔板,使电极表面受到均匀压力以抑制铁电极极板的膨胀问题 [31]。
3 锂铁电池铁电极
1997 年,Goodenough[5]等提出一种新型锂离子电池正极材料 LiFePO4,因其具有理论容量较大、成本低、无毒害、原材料来源广和高温电化学性能优异等特点而成为当前研究热点之一。锂离子电池的性价比在很大程度上取决于正极材料,Thackeray 高度评价了 LiFePO4 的发现,认为它是“锂离子电池一个新时代的到来”[32],LiFePO4 的出现预示着电动车和其他独立电源将会有新的革新。
3.1 LiFePO4 电极的充放电反应原理
该电池电极的充放电过程包括:1)充电反应 LiFePO4 - xLi + - xe-1 → (1 − x)LiFePO4 + xFePO4和2)放电反应 LiFePO4 的制备方法
(1)水热合成法。水热合成反应是指数种组分在水热条件下直接化合或经过中间态发生的化学反应。就FePO4 + xLi + + xe-1 → (1 − x)FePO4 + xLiFePO4 ,充放电反应在 LiFePO4 和 FePO4 之间循环往复进行。
3.2 LiFePO4 的制备方法
(1)水热合成法。水热合成反应是指数种组分在水热条件下直接化合或经过中间态发生的化学反应。就是将可溶性铁盐、锂盐和磷酸等原料溶解在水等溶剂中,搅拌混合均匀后,在一定温度、压强下转入通氩气保护的高压釜中反应,冷却后即制得产物 LiFePO4,这种方法对设备要求高,且不易控制,成本也较高,工业化难度很大[33-34]。
(2)溶胶凝胶法。溶胶凝胶法是将锂源、铁源和磷源按化学计量比混合,加入凝胶剂和其他添加剂,通过调节溶液的 pH 值等方法得到凝胶,然后,将凝胶在一定温度下进行热处理,得到 LiFePO4[35-37]。这种方法所得产物颗粒粒径小且分布窄,设备简单,易于操作,比表面积大,LiFePO4 的电导率和充放电效率高,稳定性强。但存在干燥体积收缩大、合成周期长等缺点[38-39]。
(3)溶胶-凝胶结合微波法。用溶胶-凝胶法制备出湿凝胶后,再用微波炉干燥,最后在微波多模腔中合成 LiFePO4 材料。这种方法具有简单易行、无污染、耗能低、耗时短等优点[40]。
(4)高温固相法。先将一定计量比的原料放入有机溶剂中(或研钵中)充分研磨,混合均匀,压块,在惰性气氛中预热处理之后再研磨,于惰性气氛中烧结为最终产品。这种方法简单方便,容易操作,但合成周期较长,产物的批次稳定性难以控制,且合成成本较高[41-42]。
(5)共沉淀法。共沉淀法一般在水溶液中进行反应,用氧化剂将 Fe2+的可溶性盐氧化成 FePO4,使锂盐与 FePO4 还原,制备 LiFePO4。这种方法合成的材料活性较高且混合均匀,煅烧温度较低,颗粒微细、粒径均匀,材料性能较好;且步骤简单,成本低等。缺点是在不易制备振实密度较大的大颗粒时,沉淀后废液处理也成为了一大难题[34]。另外,还有液相共沉法、机械活化法、高温喷射淬火法[34]、炭热还原法[43]、相变化学反应法、离子交换法[44]等。
3.3 LiFePO4 用于铁电池存在的问题和解决办法
目前,磷酸铁锂电极存在的问题是材料的电导率低,它也是目前电源研究方面的热点之一[45]。电导率低导致材料在大电流充放电时容量大幅减少,倍率放电性能差。目前,提高电导率的普遍方法有 LiFePO4表面包覆碳[46-48],掺杂金属元素如 Zn、Mo、Co 等,离子掺杂 Cr3+、Mg2+、Al3+、Ti4+、W6+等和稀土元素La、Ce、Nd 等[49-53],掺杂材料均比未掺杂时电导率高出数倍;也可通过添加导电剂大幅提高材料电导率。
4 结束语
铁电极具有诸多优点,制备高性能、低成本、环保节能的铁电池无疑成为解决目前能源短缺与环境污染问题的重要途径,也是当前新能源研究的热点。目前,主要从容量增加、材料制作、添加剂、掺杂及消除材料本身存在缺陷的解决方法等方面增强铁电极性能,根据目前的研究状况,相信在不久的将来制约铁电极广泛应用的困难将逐一被解决。
参考文献:
[1] 林智虹,陈玉峰,陈日耀,等.高铁电池及其主要影响因素[J].电池,2003,33(3):187-189.
[2] 陈建军,贾红光,任彦蓉.超铁电池的研究及展望[J].青海大学学报:自然科学版,2001(6):19-24.
[3] KOLTYPIN M, LICHT S, VERED R T, et al. The Study of K2FeO4 (Fe6+-super iron compound) as a Cathode Material forRechargeable Lithium Batteries[J]. J Power Sources, 2005, 146(1-2): 723-726.
[4] YU Xingwen, LICHT S. Advances in Fe(VI) Charge Storage: Part II. Reversible Alkaline Super-iron Batteries andNonaqueous Super-iron Batteries[J]. J Power Sources, 2007, 171(2): 1010-1022.
[5] YU Xingwen, LICHT S. Advances in Fe(VI) charge storage: Part I. Primary Alkaline Super-iron Batteries[J]. J Power Sources, 2007, 171(2): 966-980.
[6] LICHT S, GHOSH S. High Power BaFe(VI)O 4/MnO2 Composite Cathode Alkaline Super-iron Batteries[J]. J Power Sources, 2002, 109(2): 465-468.
[7] RITHIE A G, BOWLES P G, SCATTERGOOD D P. Lithium-ion/iron Sulphide Rechargeable Batteries[J]. J Power Sources, 2004, 136(2): 276-280.
[8] JUGOVIC D, USKOKOVIC D. A Review of Recent Developments in the Synthesis Procedures of Lithium Iron Phosphate Powders[J]. J Power Sources, 2009, 190(2): 538-544.
[9] TAKAHASHI M, TOBISHIMA S, TAKEI K, et al. Reaction Behavior of LiFePO4 as a Cathode Material for Rechargeable Lithium Batteries[J]. Solid State Ionics, 2002, 148(3-4): 283-289.
[10] 赵连海,李琪,乔庆东,等.锂离子电池正极材料 LiFePO4/C 的研究进展[J].化工科技,2008,16(4):56-59.
[11] 杨长春,石秋芝,侯宏英.碱性高铁电池的初步研究[J]. J Power Sources, 2002, 26(4): 293-297.
[12] RAVIKUMAR M K, BALASBRAMANIAN T S, SHUKLA A K. A Nickel-iron Battery with Roll-compacted Iron Electrodes[J]. J Power Sources, 1995, 56(2): 209-212.
[13] PERIASAMY P, RAMESH B B, VENKATAKRISHNA I S. Performance Characterization of Sintered Iron Electrodes in Nickel/Iron Alkaline Batteries[J]. J Power Sources, 1996, 62(1): 9-14.
[14] VIJAYAMOHANAN K, BALASUBRAMANIAN T S, SHUKLA A K. Rechargeable Alkaline Iron Electrodes[J]. J Power Sources, 1991, 34(3): 269-285.
[15] SOUZA C A C, CARLOS I A, LOPES M, et al. Self-discharge of Fe-Ni Alkaline Batteries[J]. J Power Sources, 2004, 132(1-2): 288-290.
[16] LICHT S, WANG B, GOSH S, et al. Insoluble Fe(VI) Compounds: Effects on the Super-iron Battery[J]. Electrochem Commun, 1999, 1(11): 522-526.
[17] LICHT S, WANG B, GHOSH S G.. Energetic Iron(VI) Chemistry the Super-iron Battery[J]. Science, 1999, 285(13). 1039-1042.
[18] 陈建军,彦蓉.固体高铁酸钡的稳定性研究[J].青海大学学报:自然科学版,2003(1):20-23.
[19] 张晓明.贮备型高铁酸钾电池的开发[D].郑州大学,2005.
[20] 刘敬发.高铁酸钡稳定性的调制及其电池性能研究[D].大庆石油学院,2007.
[21] SHUKLA A K, RAVIKUMAR M K, BALASUBRAMANIAN T S. Nickel/iron Batteries[J]. J Power Sources, 1994, 51(1-2): 29-36.
[22] CHAKKARAVATHY C, PERIASAMY P, JEGANNATHAN S, et al. The Nickel/Iron Battery[J]. J Power Sources, 1991,35(1): 21-35.
[23] Cerný J, JINDRA J, MICHK K. Comparative Study of Porous Iron Electrodes[J]. J Power Sources, 1993, 45(3):267-279.
[24] Cerný J, MICKA K. Voltammetric Study of an Iron Electrode in Alkaline Electrolytes[J]. J Power Sources, 1989, 25(2):111-122.
[25] Öjefors L. Self-discharge of the Alkaline Iron Electrode[J]. Electrochim Acta, 1976, 21(4): 263-266.
[26] CALDAS C A, LOPES M C, CARLOS I A. The Role of FeS and (NH 4)2CO3 Additives on the Pressed Type Fe Electrode[J]. J Power Sources, 1998, 74(1): 108-112.
[27] VIJAYAMOHANAN K, SHUKIA A K, SATHYANARAYANA S. Role of Sulphide Additives on the Performance of Alkaline Iron Electrodes[J]. J Electroanal Chem, 1990, 289(1-2): 55-68.
[28] BALASUBRAMANIAN T S, SHUKLA A K. Effect of Metal-sulfide Additives on Charge/Discharge Reactions of the Alkaline Iron Electrode[J]. J Power Sources, 1993, 41(1-2): 99-105.
[29] 林东风,蔡蓉,宋德瑛.铁电极中铁粉含量对其充电效率的影响[J].电源技术,2002,26(4):291-292.
[30] 林东风,蔡蓉,宋德瑛,等.多因素对铁电极充电效率的综合影响[J].电源技术,2002,32(5):274-276.
[31] 陈琼.铁-镍蓄电池开发动向[J].现代化工,1989,9(6):27-31.
[32] THACKERAY M, VAUGHEY J, FRANSSON L. Recent Developments in Anode Materials for Lithium Batteries[J]. JOM Journal of the Minerals, 2002, 54(3): 20-23.
[33] 王思敏.锂离子电池正极材料磷酸铁锂的合成及性能研究[D].北京工业大学,2008.
[34] 余仕禧,史仲,罗国恩,等.制备正极材料 LiFePO4 的研究进展[J].电池,2010,40(4):226-228.
[35] 张震,钟松材.溶胶凝胶法制备锂离子电池正极材料 LiFePO 4 [J].华南师范大学学报:自然科学版, 2009(S1):177-178.
[36] 杨华,司靖宇.溶胶凝胶法制 LiFePO4 作为锂电池正极材料的研究[J].合肥学院学报:自然科学版,2006,16(1):40-44.
[37] 尹雄鸽,黄可龙,刘素琴,等.溶胶-凝胶法制备 LiFePO4/C 复合材料及其性能[J].中国有色金属学报,2010,20(9):1748-1752.
[38] 李晨.锂离子电池正极材料 LiFePO4 的研究[D].复旦大学,2007.
[39] 王维东.锂离子电池用 LiFePO4/C 的复合碳源法制备、表征与性能研究[D].合肥工业大学,2009.
[40] 任志国,曾志亮,周建,等.溶胶-凝胶结合微波法合成 LiFePO4 材料的研究[J].材料导报,2007(S2):135-137.
[41] YAMADA A, CHUNG S C, HINOKUMA K. Optimized LiFePO4 for Lithium Battery Cathodes[J]. J Electrochem Soc,2001, 148(3): A224-A229.
[42] 唐致远,邱瑞玲,腾国鹏,等.锂离子电池正极材料 LiFePO4 的研究进展[J].化工进展,2008,27(7):995-1000.
[43] YANG S, ZAVALIJ P, STANLEY W M. Hydrothermal Synthesis of Lithium Iron Phosphate Cathodes[J]. ElectrochemCommun, 2001, 3(9): 505-508.
[44] 李国防,刘思印,李贯良.环保型锂离子电池正极材料 LiFePO4 的研究进展[J].应用化工,2009,38(4):608-611.
[45] CHUNG S, BLOKING J, CHIANG Y. Electronically Conductive Phospho-olivines as Lithium Storage Electrodes[J].Nature materials, 2002, 1(2): 123-128.
[46] RAVET N, CHOUINARD Y, MAGNAN J F, et al. Electroactivity of Natural and Synthetic Triphylite[J]. J Power Sources, 2001(97-98): 503-507.
[47] 张自禄,卢嘉春,杨裕生.碳包覆 LiFePO4 的电化学性能研究[J].第 13 次全国电化学会议论文集,2005:264-265.
[48] 曹小卫,张俊喜,颜立成,等.用不同碳源对 LiFePO4 的碳包覆改性[J].材料研究学报,2009,23(4):369-374.
[49] 赖春艳,解晶莹.Co 掺杂对 LiFePO4 结构及电化学性能的影响[J].电池,2007,37(5):342-344. 吴彬,谭晓艳. Zn2+掺杂对锂离子电池正极材料 LiFePO4 性能的影响[J].金属功能材料,2008,15(6):26-29.[50] 鲁道荣,
[51] 倪江锋,周恒辉,陈继涛,等.离子掺杂对 LiFePO4 电化学性能的影响[J].物理化学学报,2004,20(6):582-586.
[52] 胡洁梓,赵新兵,余红明,等.稀土元素掺杂对 LiFePO4 正极材料电导率和电化学性能的影响[J].功能材料,2007,38(增刊):1394-1397.
[53] 陈宇.Mo 掺杂 LiFePO4 的合成及电化学性能研究[D].北京工业大学,2008.